Лечебный свет
В ответ на повреждение в ткани реализуется ряд молекулярных событий с участием, в том числе, молекул адгезии (дословно – прилипания). Влияя на пространственно-временные характеристики этих событий, можно пытаться изменить характеристики регенеративного процесса: уменьшить воспаление и разрастание рубцовой ткани. Делать это надо предельно точно и аккуратно: иначе вместо выздоровления может развиться патологический процесс.
В качестве управляющих механизмов, триггеров молекулярных событий, исследователи пытаются использовать такие воздействия как температура, свет, электрические поля. В течение последнего десятилетия достигнуты определенные успехи в управлении биохимическими процессами в клетках in vitro с помощью световых воздействий, но при попытках перенести эти наработки на живые организмы возникали трудности.
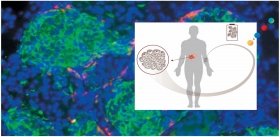
Группа ученых под руководством А. Гарсия из Технологического института штата Джорджия (США) разработала методику управления ростом кровеносных сосудов (важный фактор заживления ран) у мышей, используя ультрафиолетовый свет. Способ заживления ран с помощью света, до сих пор известный нам только из фантастических сюжетов (например, из сериала «Звездный путь»), может, таким образом, стать реальностью.
Гарсия и его коллеги использовали гель на водной основе (гидрогель), который содержал RGD-пептид. Это трипептидная аминокислотная последовательность аргинин-глицин-аспарагин, которая участвует в регуляции процессов адгезии клеток, формирования фиброзного рубца, воспаления и васкуляризации (роста сосудов). К этому пептиду присоединили молекулу-«заглушку» для того, чтобы он не активировался преждевременно. Активным RGD-пептид становился под действием ультрафиолета, который «вышибал заглушку».
Образцы гидрогеля, содержащего RGD, имплантировали под кожу на спинке мышей, которых затем подвергали действию ультрафиолета через разное время после имплантации. Если RGD активировали сразу после имплантации, иммунная система мыши распознавала его как инородное тело, развивалось воспаление и образовывался рубец. При более поздних сроках (7 и 14 дней после имплантации) иммунный ответ был гораздо слабее, и регенеративные процессы шли лучше.
В следующем эксперименте гидрогель содержал кроме RGD-пептида фактор роста эндотелия сосудов, белок, вырабатываемый клетками для стимулирования образования кровеносных сосудов. В аналогичных предыдущим экспериментах на мышах такой гидрогель стимулировал формирование кровеносной сети в месте внедрения имплантата. Это очень важный результат – прорастание в искусственный биоматериал собственной кровеносной системы животного, по которой ткань будет получать питательные вещества.
Есть и проблема. Ультрафиолетовый свет не проникает в кожу глубоко: 90% ультрафиолета поглощалось на верхних 0,5 мм шкурки мыши. Хотя оставшихся 10% хватило, чтобы активировать RGD-пептид у мыши, это ограничит подобное использование ультрафиолета у человека, так как кожа человека намного толще. Сейчас идет разработка аналогичной технологии на основе инфракрасного света, который проникает в кожу намного лучше и более безопасен. Ультрафиолет может провоцировать рак кожи, хотя 10-минутные воздействия, используемые группой Гарсия, не наносили очевидного вреда животным.
Эта работа – первая демонстрация контроля над свойствами биоматериалов под действием света, реализованная на целостном организме, а не в пробирке. Но пока это только доказательство принципиальной возможности; исследователи стимулировали кровеносные сосуды к росту, но этот рост был таким же, как если бы сосуды выросли и в отсутствие RGD-пептида. Следующим шагом должно стать прицельное управление включением молекулярных сигналов. При этом варианты практического применения технологии видны уже на текущем этапе. Так, Дж. Эллиссиф из Университета Джонса Хопкинса в Балтиморе (США) считает, что описанную технологию можно использовать при вживлении больным сахарным диабетом датчиков глюкозы для непрерывного контроля глюкозы в крови.
По: News.ScienceMag; Nature
Подготовила Мария Перепечаева